技术服务 ▼
双分子荧光互补(BIFC)实验服务
Hu等在2002年最先报道了一种直观、快速地判断目标蛋白在活细胞中的定位和相互作用的新技术——双分子荧光互补(Bimo-lecular fluorescence complementation,简称BiFC)。
双分子荧光互补是一项可直观、快速判断目标蛋白在活细胞中的定位和相互作用的新技术。该技术利用在荧光蛋白特定位点插入外源片段而不影响GFP荧光活性的特性,在其分割为两个无荧光活性的蛋白片段, 即N端片段(N-fragment)和C端片段(C-fragment),当能够发生相互作用的两个蛋白分别与N端片段和C端片段连接形成融合蛋白并在活细胞中共同表达时, 荧光蛋白的N端片段与C端片段就能够相互靠近, 重新形成活性的荧光基团而发出荧光。
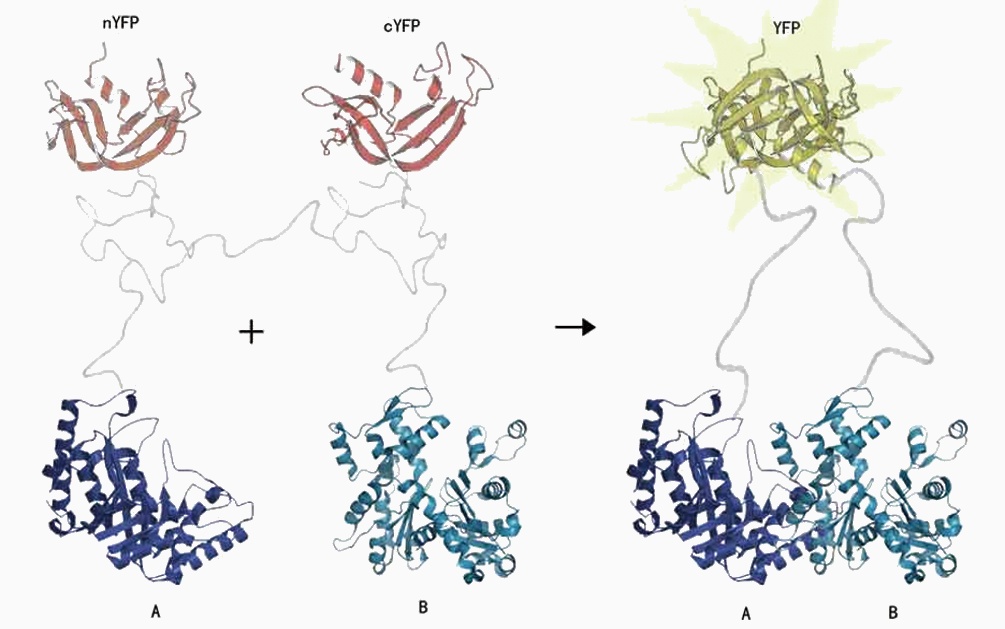
在绿色荧光蛋白GFP的基础上,也衍生出蓝色荧光蛋白BFP,青色荧光蛋白CFP和黄色荧光蛋白YFP等,这些荧光蛋白都可以用于BiFC 实验。
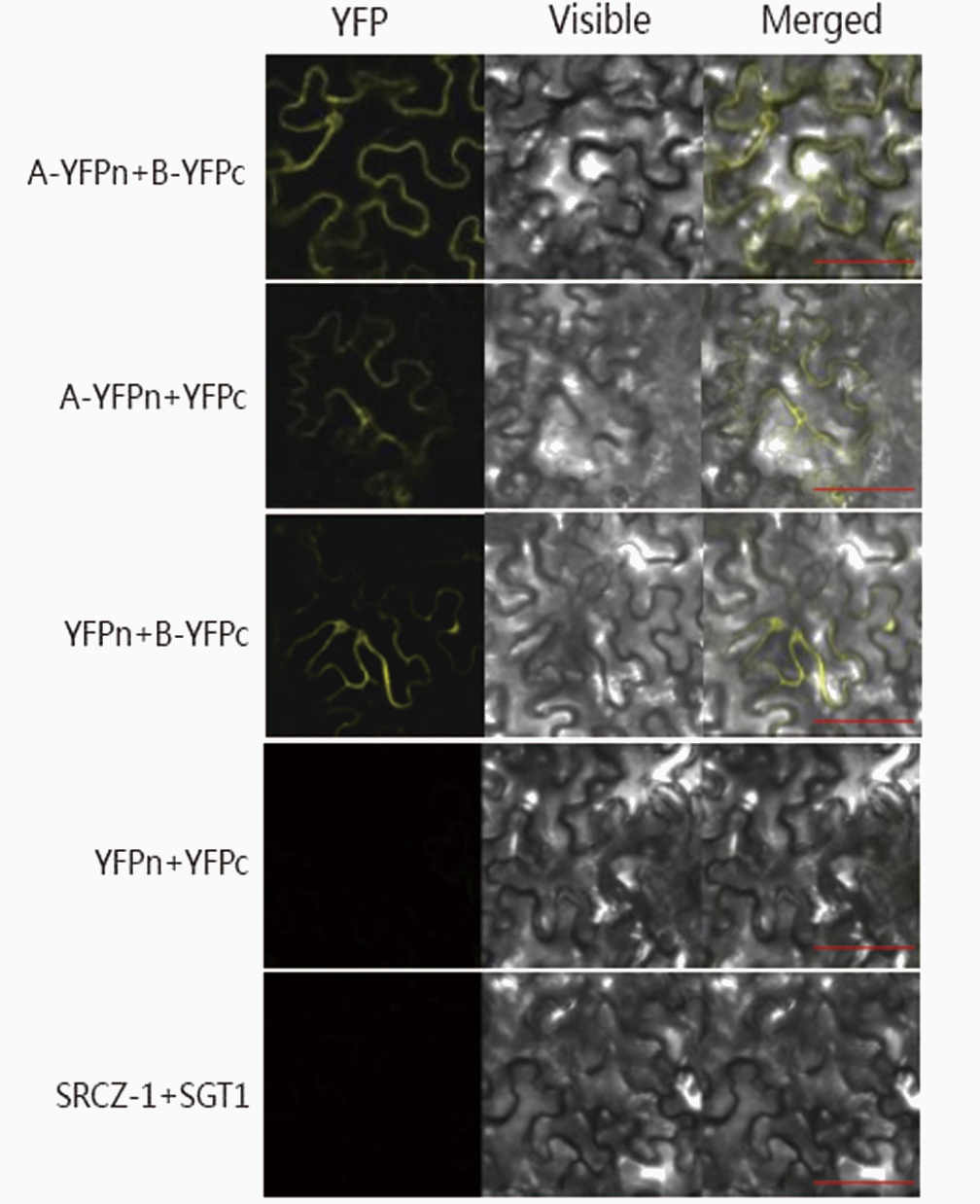
BiFC 系统介绍
1. Split fluorescent protein(YFP)普通型:
该系统适合蛋白相互作用较强的蛋白互作研究,YFP荧光强度控制在较低的水平,不受背景等因素干扰。
2. Split fluorescent protein(YFP)增强型:
该系统适合膜蛋白互作等蛋白之间相互作用较弱的蛋白互作研究,YFPn和YFPc经过人工编辑,YFP荧光增强,便于观察互作弱的荧光信号。同时对206位氨基酸A进行突变成K,降低了背景等因素干扰,结果真实可靠。
3. The split luciferase (LUC) system:
该系统可以对活体系统观察拍照,尤其可进行定量分析,比较互作强弱,适合蛋白互作受第三方物质影响的互作研究,如蛋白互作的强弱能够被激素、小分子化合物等调节,通过外源添加激素化合物等观察判定互作的强弱变化
BiFC 技术的优缺点
优点 | 缺点 |
1、适用于体内和体外蛋白相互作用的验证,双分子荧光互补实验可以在真正的体内细胞环境中进行,对于分子生物学和生物医学研究具有重要意义。且实验周期短。 | 1、对系统温度敏感,温度太高,片段不易互补形成完整的荧光蛋白。一般要求在30℃以下的实验环境,温度越低,越有利于片段的互补,这对研究细胞在生理条件下的蛋白相互作用不利; |
2、实验中的蛋白处于天然状态,并能直观观察蛋白相互作用在细胞中的定位。 | 2、观察到的双分子荧光信号滞后于蛋白的相互作用过程,不能实时观察蛋白相互作用或蛋白复合物的形成过程。 |
3、双分子荧光互补实验不需要以原位方式对样品进行标记,避免了样品结构和功能的改变。 | 3、双分子荧光互补实验需要将两个受体分子各自连接到不同的荧光蛋白上,这个过程可能会导致蛋白的结构变化或功能损失。 |
4、相对于FRET和BRET技术对仪器的要求高、数据处理复杂的情况,BiFC只需要荧光倒置显微镜,数据处理简单,只检测荧光的有无,背景干净,检测更灵敏,不依赖于其他次级效应。 | 4、双分子荧光互补实验需要在相同的细胞或组织中表达两个融合蛋白,并且这两个蛋白的表达水平需要相等。因此,在实验设计和数据分析中需要考虑到这些因素的影响。 |
5、双分子荧光互补实验能够有效地鉴定蛋白质的相互作用,特别是可以检测低亲和力的蛋白相互作用或瞬间相互作用。 | 5、双分子荧光互补实验对于某些靶标不适用,比如一些细胞膜结构和信号转导通道,这些结构可能阻碍荧光蛋白的结合。 |
6、不需要蛋白有特别的理论配比,能检测到不同亚群蛋白间的相互作用。 |
BIFC 技术的应用
(一)验证蛋白质之间是否存在相互作用,可与酵母双杂、Co-IP等实验结果相互验证;
(二)BiFC实验还能对细胞内蛋白相互作用的位置进行研究。
BIFC 服务内容
服务项目 | 服务内容 | 周期 | 交付 | 价格 |
表达质粒构建 | 基因优化 | 1-2周 | 1、完整的实验报告,包括详细的实验步骤及结果 | 询价 |
亚克隆设计 | ||||
合成基因 | ||||
亚克隆至载体 | ||||
BiFC实验 | 农杆菌转化 | 1-4周 | ||
互作蛋白瞬时表达 | ||||
实验结果观察拍照 |



