技术服务 ▼
微量热涌动(MST)实验服务
微量热泳动(MicroScale Thermophoresis,MST) 是一种定量分析生物分子间相互作用的前沿技术。通过精确检测荧光变化,结合灵敏的热泳动现象,MST 提供了一种灵活、强大和快速测量分子间相互作用的方法。
微量热涌动的优势
1、样品处理方面:
l 不需要固定,在生物溶液中测量,无需纯化
l 无需标记测量
l 使用荧光染料/荧光蛋白具有良好的选择性
l 极低的样品消耗量
l 直接在脂质体或者去污剂中研究膜蛋白
l 研快速简单的实验准备
2、数据处理方面:
l 10分钟之内测术任何(生物)分子间亲和力(KD,解离常数)
l 测量sub-nM到mM级的解离常数
l 可以选择特定温度下完成测量
l 研究各种不同大小的分子:离子、片段、核小体、脂质体
l 可以在各种不同的溶液环境中完成测量,包括研究膜蛋白所需的复杂的去污剂环境女广泛的样品兼容性:天然的环境中、生理学实验条件、血清、细胞裂解液☆可以研究多组分反应:三元复合物、装配顺序、干扰因素、协同作用、类似物女可以区分靶标上不同的结合位点
l 可以测量生物分子的寡聚化
l 研究化学计量学并确定生物分子结合位点的数目
l 研究结合能量学ΔG(自由能),H(焓)和ΔS(熵)
l 研究蛋白的折蟊和稳定性
3、实验操作方面:
l 非常简单易操作
l 实时获得数据
l 非常稳定的技术
4、维护费用方面:
l 非常低的运行成本
l 不需要日常的仪器维护
l 更快得到数据用于发表文章
l 仪器小型化设计,占用空间少
微量热涌动(MST)检测原理
微量热泳动(MST)是粒子在微观的温度梯度中的定向运动。通过测量水化层的变化(通常是由生物分子结构/构象的变化引起的)而导致的微量热泳动的变化来确定亲和力。甚至像蛋白质磷酸化或小分子结合到靶标上这些微小的变化都可以被测量到。微量热泳动(MST)也允许直接在溶液中测量分子间相互作用,而不需要一个固定的表面(无需固定)。微量热泳动(MST)是由总部设在慕尼黑的德国高科技公司NanoTemper技术有限公司发展出来的。
微量热泳动(MST)可以定量分析溶液中微升的分子间的相互作用。微量热泳动(MST)是基于微量热泳动效应,即沿温度梯度定向的分子运动。一个空间的温度差ΔT导致分子浓度在温度升高的地区的变化,用Soret系数ST定义为:C热/C冷= EXP(-STΔT)。
热泳动取决于分子和溶剂之间的界面。在恒定的缓冲条件下,热泳动反映出分子大小,电荷和溶剂化熵。 一个荧光标记分子A的热泳动由于大小、电荷和溶剂化熵的差异通常明显不同于分子A和靶标T形成的复合物AT。这种热泳动的区别可以用来通过梯度滴定实验,在一定缓冲条件下,测量计算出分子间的结合常数。
测量荧光标记分子的热泳运动是通过监测毛细管内的荧光分布F。红外激光产生微观的温度梯度。溶液在激光光斑处的温度升高ΔT= 5 K,之前的红外激光是在同质化的荧光分布F是毛细管内观察到的冷切换。当红外激光打开后,两方面因素影响荧光的分布(热弛豫时间和荧光标记分子的热泳动),但是由于其时间尺度分离(热弛豫时间很短和荧光标记分子的热泳动时间较长),有利于我们测量荧光分布F热。在较慢的热泳动时间内(10秒),分子运动从局部加热区域移往四周的低温地区,中心区域的分子浓度降低,由于质量扩散效应的反作用,最后分子的分布直到达到一个稳定态。
虽然质量扩散D的决定消耗的动力学,S、T确定的稳态浓度比例下温度上升Chot/Ccold=exp(-ST ΔT) ≈ 1-STΔT。归一化荧光Fnorm= F热/ F冷主要是这个浓度比,除了温度跳跃∂F /∂T的线性近似,我们发现:Fnorm= 1 +(∂F /∂TST)的温差。由于荧光强度的线性和热泳枯竭,Fnorm(A)未结合的分子归荧光和约束复杂的Fnorm(AT)线性叠加。 表示x的绑定到目标分子的一小部分,在目标T滴定的荧光信号不断变化的计算公式如下:Fnorm=(1-x) Fnorm(A)+x Fnorm(AT)。
定量绑定参数获得通过的约束力基板的连续稀释。通过绘制F规范对系列稀释的不同浓度的对数,获得一个S形的结合曲线。这种结合曲线,可以直接安装质量作用定律的非线性解与解离常数K ð,作为结果。微量热泳动(MST)是一种分析生物分子的技术。微尺度热泳是粒子在微观的温度梯度中的定向运动。
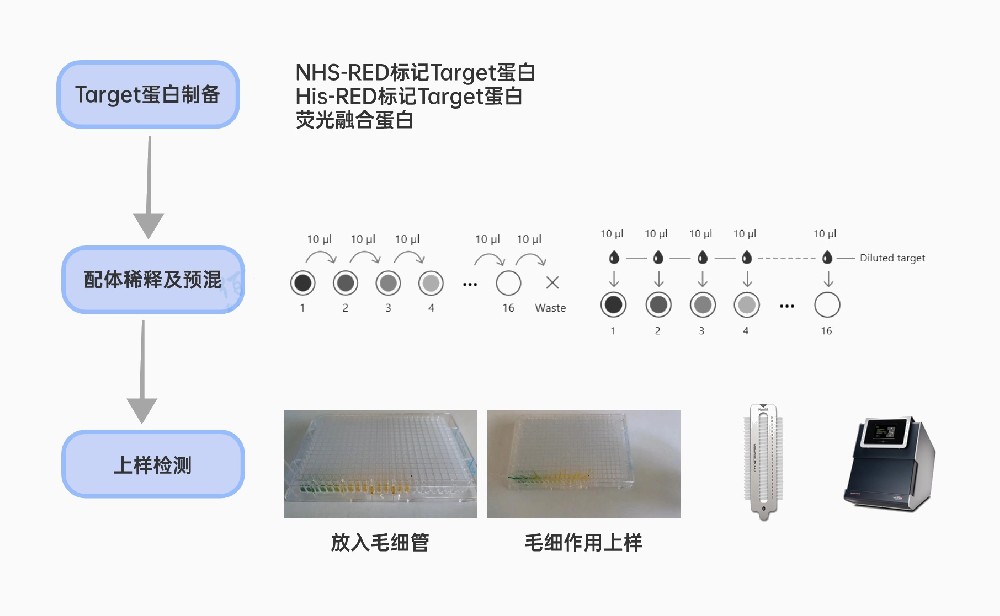
根据Target蛋白的制备方式不同,MST实验有下面三种常用的实验设计方式:
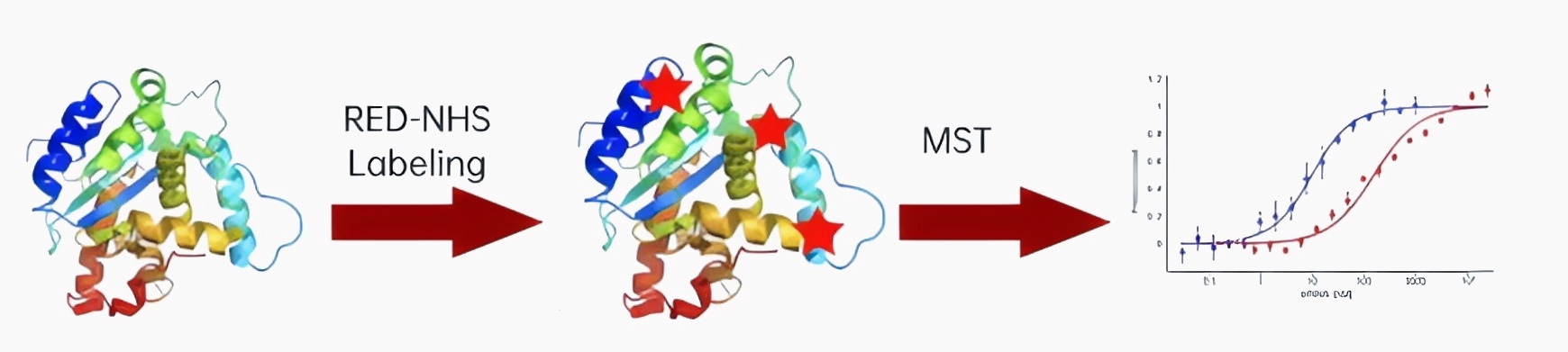
1、氨基偶联标记纯化的蛋白
2、RED-tris-NTA标记His标签蛋白
![]()
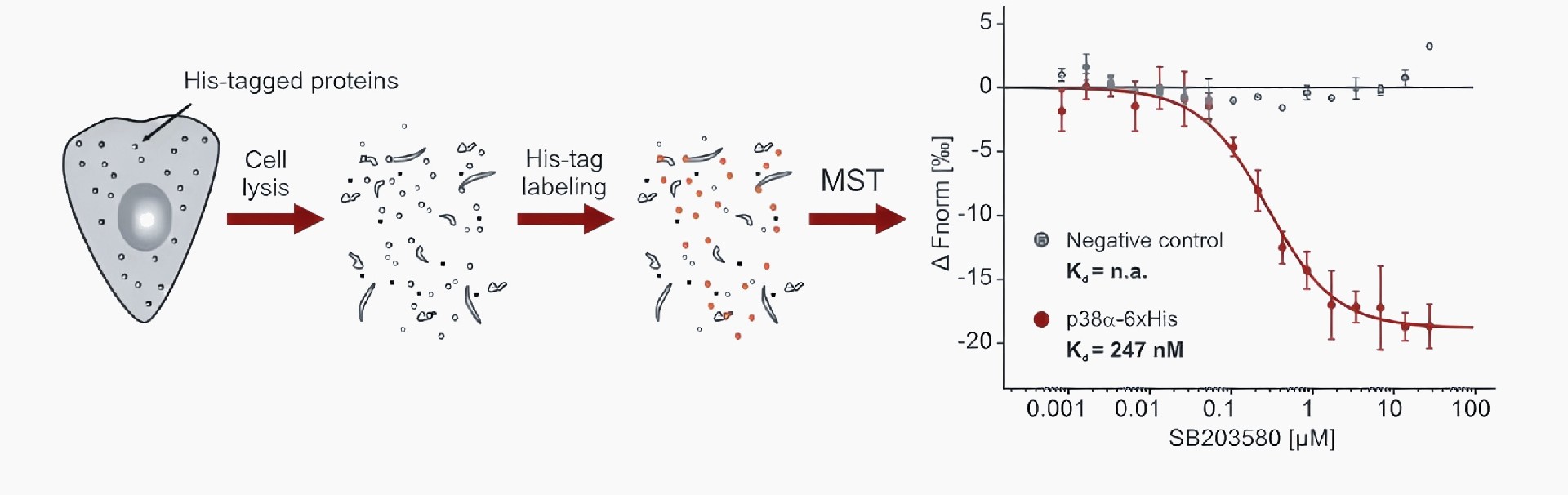
利用偶联了荧光染料(NT-647)的NTA分子可以特异性结合6 x His的能力特异性标记带His标签的蛋白,从而在即便没有纯化蛋白的情况下也可以进行MST实验。
3、荧光融合蛋白
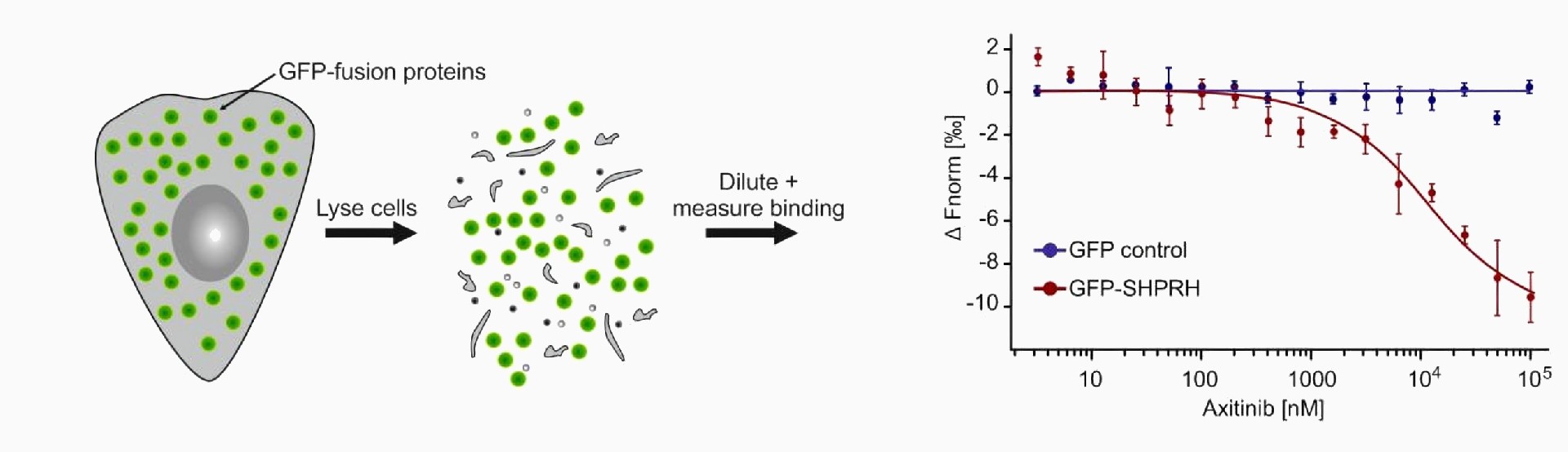
微量热泳动应用
l 蛋白与蛋白相互作用
l 蛋白与小分子相互作用
l 多肽-多肽相互作用
l 蛋白与核酸相互作用
l 核酸适配子与小分子相互作用



